به گزارش پایگاه خبری تحلیلی رادار اقتصاد به نقل از وزارت بهداشت، با توجه به اعطای مجوز مصرف اضطراری واکسن کووایران-برکت از سوی سازمان غذا و دارو و با توجه به وجود فاصله زمانی ارائه گزارش به رگولاتوری تا چاپ مقاله در یک ژورنال علمی، شرکت سازنده واکسن کووایران تلاش دارد تا جهت اطلاع رسانی بهتر، مجموعه گزارشاتی کوتاه از نتایج و یافته های مطالعات بالینی را به مرور در اختیار علاقمندان قرار دهد.
در این رابطه پس از گزارش یافته های Pre-clinical، دومین گزارش خود با عنوان «خلاصه یافته های مطالعات انسانی فاز یک و دو واکسن کووایران-برکت» را با جامعه به اشتراک می گذارد.
در ادامه این گزارش، یافته های تکمیلی مطالعات نیز به همراه یافته های اولیه فاز سه در دسترس قرار خواهد گرفت. به این ترتیب جامعه علمی از این طریق و تا قبل از انتشار مقالات علمی با فرایند پیشرفت مطالعات در فازهای قبلی مطالعات واکسن کووایران بیشتر آشنا می شود.
خلاصه طرح مطالعات واکسن کووایران برکت:
اولین مطالعه کارآزمایی بالینی واکسن کووایران برکت با هدف بررسی بی خطری واکسن در جمعیت سالم ۱۸ تا ۵۰ سال (IRCT۲۰۲۰۱۲۰۲۰۴۹۵۶۷N۱) در تاریخ ۹ دی ماه ۱۳۹۹ آغاز و در تاریخ ۱۴ اسفند ۱۳۹۹ با تزریق دوم آخرین داوطلب خاتمه یافت.
۵۶ داوطلب به صورت تصادفی به سه گروه پلاسبو (۸ نفر)، واکسن ۳ میکروگرم (۲۴ نفر) و واکسن ۵ میکروگرم (۲۴ نفر) تخصیص داده شدند و دو دوز تزریق واکسن /پلاسبو را به فاصله ۱۴ روز دریافت کردند.
تمامی داوطلبان ۷ شبانه روز پس از هر تزریق در محل انجام مطالعه اقامت داشتند و تمامی علائم ایشان به صورت شبانه روزی ثبت می شد. در ادامه نیز ثبت علائم بصورت گزارشات داوطلبان، معاینه پزشکی و انجام آزمایشات دوره ای انجام شد.
بخش دوم فاز یک واکسن کووایران برکت با هدف بررسی بی خطری و ایمونوژنیسیتی واکسن بر روی ۳۲ داوطلب سالم ۵۱ تا ۷۵سال (IRCT۲۰۲۰۱۲۰۲۰۴۹۵۶۷N۲) در تاریخ ۲۵ اسفند ۱۴۰۰ آغاز وی در تاریخ ۲۰ فروردین ۱۴۰۰ با تزریق دوم آخرین داوطلب خاتمه یافت.
این داوطلبان به صورت تصادفی به دو گروه پلاسبو (۸ نفر) و واکسن ۵ میکروگرم (۲۴ نفر) تخصیص یافتند. دوز ۵ میکروگرم دوز منتخب از مطالعه قبلی فاز یک بود که با توجه به پاسخ ایمونوژنیسیتی بهتر داوطلبان انتخاب شد.
دو تزریق واکسن/ پلاسبو به فاصله ۱۴ روز برای داوطلبان انجام شد. تمامی داوطلبان ۴ شبانه روز (۲ شبانه روز پس از هر تزریق) در محل انجام مطالعه جهت بررسی دقیق علائم و عوارض احتمالی اقامت داشتند. ثبت علائم در این داوطلبان نیز بصورت گزارشات داوطلبان، معاینه پزشکی و انجام آزمایشات دوره ای بود.
در مطالعه فاز ۲ واکسن کووایران برکت (IRCT۲۰۲۰۱۲۰۲۰۴۹۵۶۷N۳) از تاریخ ۲۵ اسفند ۱۳۹۹ تا ۴ خرداد ۱۴۰۰ تعداد ۲۸۰ داوطلب (۲۰۰ شرکت کننده ۱۸-۵۰ سال و ۸۰ شرکت کننده ۵۱-۷۵ سال) واکسن ۵ میکروگرم (۲۲۴ نفر) و پلاسبو (۵۶ نفر) را به صورت دو دوز تزریق عضلانی به فاصله ۲۸ روز، با هدف اصلی بررسی ایمنی زایی واکسن ۵ میکروگرم دریافت کردند.
در ادامه مطالعه فاز سوم (IRCT۲۰۲۰۱۲۰۲۰۴۹۵۶۷N۳) با هدف اصلی تعیین اثربخشی واکسن در تاریخ ۵ اردیبهشت ۱۴۰۰ بر روی جمعیت هدف ۲۰ هزار نفر در محدوده سنی ۱۸ تا ۷۵ سال آغاز شد. دو سوم شرکت کنندگان در این مطالعه به تصادف واکسن ۵ میکروگرم و یک سوم افراد پلاسبو دریافت می کنند.
اثربخشی مطالعه بر اساس میزان ابتلا به بیماری شدید/ متوسط / خفیف دو هفته پس از دریافت دوز دوم واکسن برآورد می شود.
خلاصه نتایج ایمنی و ایمنی زایی مطالعات واکسن کووایران برکت:
بررسی داده های مجموعه مطالعات واکسن کووایران برکت تا تاریخ ۲۴ خرداد ۱۴۰۰ نشان می دهد که واکسن کووایران در دوز ۵ میکروگرم (دوز نهایی شده از فاز یک جهت استفاده در مطالعات فاز ۲ و ۳) به خوبی تحمل می شود و تا کنون هیچ رخداد نامطلوب جدی (Serious Adverse Events SAEs) مرتبط با این واکسن مشاهده نشده است.
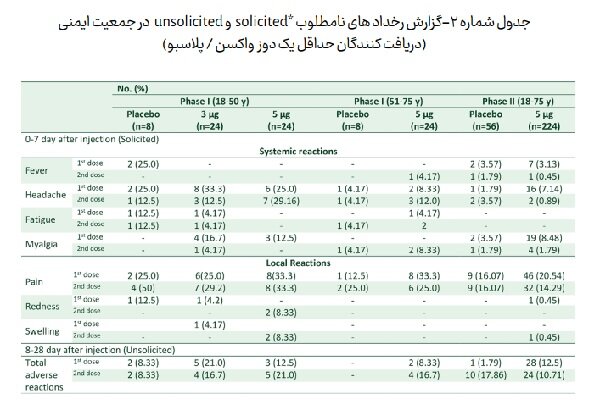
تحلیل عوارض جانبی مرتبط (Related adverse reactions) ثبت شده در ۳۶۸ داوطلب (در فاز یک و فاز دو) که حداقل یک دوز واکسن دریافت کرده اند، نشان داد که بیشترین عارضه گزارش شده توسط داوطلبان شامل درد محل تزریق، درد عضلانی، ضعف و سردرد است که اکثریت آنها نیازی به مداخله پزشکی نداشته و یا با مصرف مسکن خوراکی توسط داوطلب کمتر از ۲۴ ساعت برطرف شده است. (جدول شماره ۲).
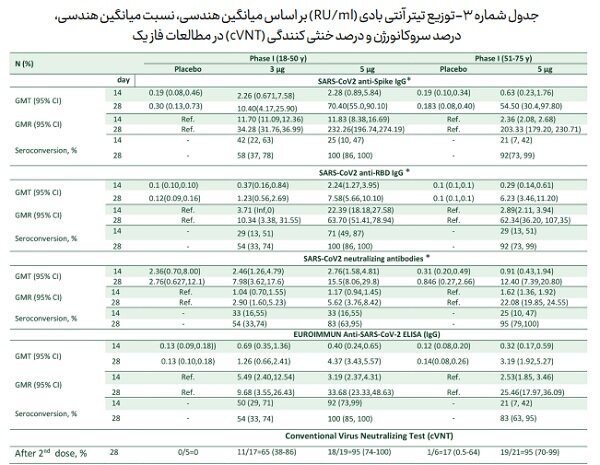
نتایج ایمنی زایی مطالعه فاز یک داوطلبان کمتر از پنجاه سال نشان داد که پاسخ ایمنی ایجاد شده توسط واکسن ۵ میکروگرم نسبت به ۳ میکروگرم در دو تزریق به فاصله ۱۴ روز، پاسخ مطلوب تری را دو هفته بعد از دوز دوم ایجاد می کند (۱۰۰ درصد سروکانورژن در anti-Spike IgG SARS-CoV۲ neutralizing antibodies SARS-CoV۲ و ۸۳ درصد در anti-RBD IgG ، SARS-CoV۲
مطالعه فاز یک ۵۱ تا ۷۵ سال نیز تایید شد، به طوری که میزان سروکانورژن در تمامی آنتی بادی ها بالاتر از ۹۰ درصد گزارش شد.
(به جز ELISA IgG ۲-EUROIMMUN Anti-SARS-CoV که این میزان ۸۳ درصد برآورد شد.
مهم ترین یافته قابل اطمینان در مطالعات فاز یک نتایج تست خنثی سازی ویروس (Conventional Virus Neutralizing Test cVNT) بود که نشان می دهد ۹۵ درصد سرم افراد دریافت کننده دو دوز واکسن ۵ میکروگرم به فاصله دو هفته می تواند منجر به خنثی سازی ویروس با رقت بیش از ۱/۱۶ بشود (جدول شماره ۳).
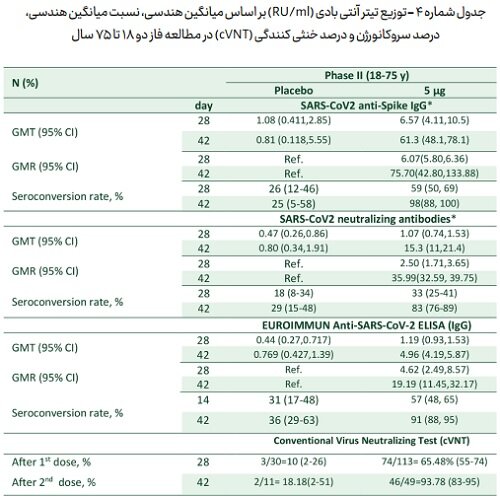
ادامه مطالعات واکسن کووایران با مطالعه فاز دوم با تزریق واکسن ۵ میکروگرم (با فاصله ۴ هفته، بر خلاف فاصله ۲ هفته در فاز اول) نشان داد که همانند یافته های سایر مطالعات پیشنهاد دهنده این افزایش فاصله تجویز واکسن، تغییر فاصله دو هفته به ۴ هفته، سیستم ایمنی هومورال را بطور موثرتری تحریک می کند.
نسبت میانگین هندسی تیتر آنتی بادی دریافت کنندگان واکسن به پلاسبو (Geometric Mean Ratio) نشانگر ۷۶ برابر شدن تیتر IgG anti-Spike SARS-CoV۲ و ۳۶ برابر شدن neutralizing antibodies SARS-CoV۲ شده است.
نتیجه تست cVNT نیز مشخص کرد که که حدود ۹۴ درصد داوطلبان در روز ۴۲ قادر به خنثی سازی ویروس وحشی هستند. این مقدار در گروه پلاسبو ۱۸ درصد مشاهده شد که قابل انتساب به ابتلای بدون علامت داوطلبان در طول مطالعه است. (همگی داوطلبان در آزمایشات پایه PCR منفی و تست آنتی بادی نوترالیزان منفی داشتند).
تجمیع نتایج تست خنثی سازی ویروس cVNT افراد واکسینه با دوز ۵ میکروگرم در فاز یک و دو نشان داد که سرم ۹۳.۵ درصد داوطلبان قادر به خنثی کردن ویروس است. (نمودار شماره ۱)
در مطالعه فاز ۳ تا تاریخ ۲۴ خرداد، ۹۰ درصد داوطلبین (۱۸ هزار داوطلب از مجموع ۲۰ هزار داوطلب) تزریق اول و بیش از ۲ هزار داوطلب هر دو دوز واکسن/ پلاسبو را دریافت کرده اند. تاکنون حدود ۶ هزار تماس با سامانه تلفنی ۲۴ ساعته برقرار شده است.
۲۳۰ داوطلب برای اطمینان از سلامتی جهت ویزیت حضوری مراجعه داشته اند. عوارض گزارش شده توسط داوطلبان تاکنون همگی عارضه خفیف طبقه بندی شده است. تعداد ۶۳ داوطلب PCR مثبت داشتند که همگی آنها قبل از تزریق دوم بوده است.
۵۴ داوطلب درمان سرپایی دریافت کرده اند و ۹ بیمار در بیمارستان بستری شده اند که مراحل درمانی خود را طی می کنند (این گزارش شامل تمام موارد بستری علاوه بر ابتلا به کووید همانند شکستگی ناشی از تروما و ... نیز است.)
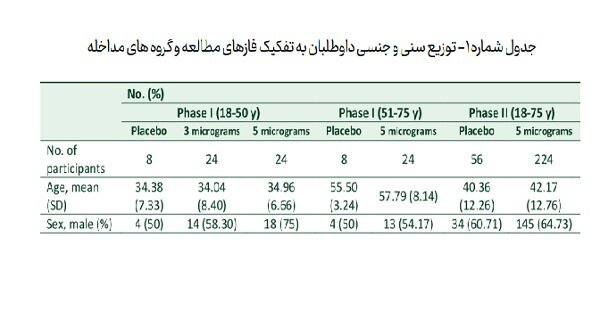
جدول شماره ۱ توزیع سنی و جنسی داوطلبان به تفکیک فازهای مطالعه و گروه های مداخله
هیچ گونه تغییر غیرطبیعی در آزمایش های خون داوطلبان طی دوره پیگیری در داوطلبان فاز یک رخ نداده است.
تمامی عوارض ثبت شده عوارض خفیف بودند به جز:
* مطالعه فاز یک ۱۸تا ۵۰ سال: یک مورد افت فشارخون و یک مورد سردرد با درجه ۲ طبقه بندی، یک مورد ابتلا به کووید قبل از دوز دوم در گروه سه میکروگرم
* مطالعه فاز یک ۵۱ تا ۷۵ سال: یک مورد ابتلا به کووید- ۱۹ یک روز بعد از تزریق دوم در گروه ۵ میکروگرم، یک مورد افت پلاکت در گروه پلاسبو بهبود یافته بدون نیاز به اقدام درمانی
* مطالعه فاز دو ۱۸ تا ۷۵سال: دوازده مورد ابتلا به کووید- ۱۹ (۹ مورد از ۲۲۴ داوطلب، ۳ مورد از ۵۶ داوطلب، همگی قبل از دریافت دوز دوم به جز دو مورد در گروه پلاسبو)
جدول شماره-۳ توزیع تیتر آنتی بادی (RU/ml) بر اساس میانگین هندسی، نسبت میانگین هندسی، درصد سروکانورژن و درصد خنثی کنندگی (cVNT) در مطالعات فاز یک
جدول شماره- ۴ توزیع تیتر آنتی بادی (RU/ml) بر اساس میانگین هندسی، نسبت میانگین هندسی، درصد سروکانورژن و درصد خنثی کنندگی (cVNT) در مطالعه فاز دو ۱۸ تا ۷۵ سال
نمودار شماره-۱ برآورد کلی (pooled estimate) از نسبت داوطلبانی که سرم ایشان دو هفته پس از تزریق دوم واکسن (روز ۴۲) قادر به خنثی سازی ویروس (بر اساسcVNT) بوده است. (رقت های بیش از ۱/۱۶)

- نتایج مربوط به دریافت کنندگان واکسن ۵ میکروگرم است.

نظر شما